News Pharmacienne cantonale
2025
19 novembre : HPC - Publication des mises à jour de l’information professionnelle relatives à la sécurité
Nous vous prions de trouver ci-après une information émanant de Swissmedic concernant les mises à jour des informations professionnelles relatives à la sécurité:
Swissmedic souhaite vous informer qu’il publiera, à partir de novembre 2025, les mises à jour des informations professionnelles relatives à la sécurité.
La HPC correspondante est publiée sur le site Internet de Swissmedic, sous la rubrique « (Direct) Healthcare Professional Communications ».
En résumé :
- Dès novembre 2025, un tableau récapitulatif des mises à jour des informations professionnelles (« Safety Update –Mises à jour de l’information professionnelle », cf. illustration) auxquelles de nouvelles données de sécurité ont été intégrées sera envoyé chaque mois avec la newsletter Sécurité des médicaments. S’abonner à la newsletter Sécurité des médicaments : Services d'information – s’abonner aux newsletters.
- Ce tableau offre aux professionnels de santé une vue d’ensemble claire des principes actifs dont l’information professionnelle a été mise à jour avec de nouvelles données de sécurité. De plus, une liste cummulative de toutes les mises à jour des informations professionnelles relatives à la sécurité sera disponible sous forme de fichier Excel sur le site web de Swissmedic, à l’adresse swissmedic.ch/safetyupdates.
30 octobre : Lancement de la campagne de communication "Consultation en pharmacie"
Dans le contexte du désengorgement des services d’urgences en période de grippe et autres virus hivernaux, une campagne de communication axée sur la valorisation de la consultation en pharmacie sera lancée dès le 4 novembre 2025.
Cette campagne est soutenue conjointement par le DSAS et la Société vaudoise de pharmacie dans le cadre du partenariat public-privé (PP).
Elle a pour objectif de valoriser la consultation en pharmacie auprès de la populationvaudoise et de renforcer le rôle des pharmacies en tant qu’acteurs du réseau de soins primaires.
En outre, elle vise à informer la population vaudoise, de la possibilité de pouvoir bénéficier d’une consultation en pharmacie, avec remise si besoin de médicaments soumis à prescription médicale.
La campagne cible en particulier les adultes dès 16 ans, sans médecin traitant ou en cas d’indisponibilité du médecin ainsi que les personnes ayant un problème bénin et hésitant à se rendre aux urgences.
Cette campagne s’inscrit aussi dans la continuité des communications menées ces dernières années autour du désengorgement des urgences.
Les messages clés sont les suivants :
- Les pharmacies proposent un accès direct sans rendez-vous, à des horaires étendus, pour obtenir un premier conseil professionnel en cas de problème de santé.
- Elles sont un point d’orientation et de triage, pour tous les âges, en cas de doute sur la nécessité de consulter un médecin.
- Certaines pharmacies proposent des consultations pour les personnes dès 16 ans, sans médecin traitant ou dont le médecin n’est pas disponible.
- Les consultations sont menées par des pharmaciens formés et respectent les exigences légales en vigueur.
- Lors des consultations, certains médicaments habituellement soumis à prescription médicale peuvent être délivrés sans ordonnance, dans des situations cliniques bien définies.
- Le tarif de la consultation, à partir de 20.- peut varier selon les pharmacies, est payable sur place. Le prix des médicaments est à payer en sus. Certains modèles d’assurance-maladie prennent en charge ces frais (réseaux de soins intégrés).
Vous trouverez ci-dessous les supports de communication que vous pouvez directement imprimer pour promouvoir la campagne dans vos pharmacies à savoir :
- Les pdf des flyers au format A5 pour impression pharmacie et pour communication sur le web
- Les pdf de l’affiche au format A3 pour impression pharmacie et pour communication sur le web
Une affiche imprimée au format A3 vous parviendra prochainement par courrier par le biais de la Société vaudoise de pharmacie.
Les pharmacies sont en première ligne de cette campagne et nous espérons que vous lui ferez bon accueil dans vos pharmacies !
Affiche à imprimer (pdf, 9.00 Mo)
Affiche WEB (pdf, 9.00 Mo)
Flyer à imprimer (pdf, 9.00 Mo)
flyer WEB (pdf, 9.00 Mo)
9 octobre 2025: Remboursement des préparations magistrales dans le contexte d’une lacune de l’offre
Lors de la formation intitulée « bonnes pratiques de fabrication en pharmacie » organisée dans le cadre du cycle de conférences de la société vaudoise de pharmacie, la question du remboursement des préparations magistrales dans le contexte d’une lacune de l’offre nous avait été posée. Il nous a ainsi semblé utile de vous proposer un rappel des conditions de remboursement par l’assurance obligatoire des soins des médicaments fabriqués sous forme de préparations magistrales lors de lacunes d'approvisionnement.
Les règles de remboursement dans ce contexte sont décrites dans la Liste des médicaments avec tarif (LMT) sous dispositions générales selon le code 1.9 .
Nous profitons de vous informer qu’une nouvelle version de la Liste des médicaments avec tarif a été publiée au 1er juillet 2025 et disponible à l’adresse suivante : www.bag.admin.ch/fr/liste-des-medicaments-avec-tarif-lmt
En cas de lacune de l’offre, si les conditions du ch. 1.9 let. b. à e. des dispositions générales de la LMT sont réalisées, il appartient à l’assureur-maladie de prendre en charge la préparation magistrale élaborée par le pharmacien sans garantie préalable de prise en charge.
Dans ces circonstances et en application du principe de territorialité, il n’existe pas d’obligation pour le pharmacien de déterminer si un médicament pourrait être importé et se révéler meilleur marché.
En revanche, il est important que la pharmacie respecte les exigences de la LMT et puisse fournir tous les justificatifs. Dans le cas contraire, les assurances maladie pourraient refuser le remboursement des préparations magistrales.
En cas de rupture de stock temporaire, conformément aux dispositions légales (art. 69b, al. 1, de l'Ordonnance du 27 juin 1995 sur l'assurance-maladie (OAMal ; RS 832.102)), les assureurs-maladie peuvent rembourser les médicaments s’ils ont été importés ou fabriqués par voie réglementaire. Ceci s'applique à condition que les médicaments soient effectivement autorisés en Suisse, figurent sur la liste des spécialités et que les conditions soient toutes remplies dans le cas spécifique.
Il est important de noter que selon la directive du 29 avril 2025 de l’OFSP (pdf, 124 Ko), les pharmacies doivent documenter leur choix et sur demande fournir aux assureurs-maladie la preuve que le médicament est indisponible en Suisse ou dans le cas de la fabrication d’une préparation magistrale, qu’une importation n’était pas possible.
Enfin pour rappel, l'article 69b de l'OAMal ne s'applique pas aux médicaments qui ne sont pas ou plus autorisés en Suisse. Dans ce cas, les conditions habituelles de remboursement des médicaments non autorisés et non-inscrits sur la liste des spécialités s'appliquent et le remboursement ne peut être effectué que si une garantie de remboursement a été demandée et approuvée par la caisse maladie avant le traitement.
8 octobre : Attestation pour la prescription et l'obtention de médicaments
Vous trouverez ci-après une communication émanant du Médecin cantonal et de la Pharmacienne cantonale en lien avec la prescription et l’obtention de médicaments par des médecins retraités ainsi que son annexe y relative.
Communication (pdf, 59 Ko)
Annexe (pdf, 46 Ko)
24 septembre : Stock de réserve de médicaments non nominaux dans les EMS et les EPSM
À la suite de signalements transmis par le CIVESS, organe de surveillance en charge du contrôle des établissements cités en titre, nous constatons que des stocks de médicaments dit de réserve et non attribués à des patients sont fréquemment rencontrés.
Selon l’article 27 du règlement sur les établissements sanitaires du 26 janvier 2011 (RES ; BLV 810.03.1) (pdf, 63 Ko), l’établissement qui acquiert des médicaments et tient une pharmacie non accessible au public pour les traitements effectués dans l’établissement doit demander une autorisation au département. Toutefois, l’établissement qui détient des médicaments acquis directement au nom des patients n’est pas soumis à cette obligation. Par conséquent, les EMS et les EPSM qui n’ont pas cette autorisation de stockage de médicaments sont tenus de ne détenir que des médicaments au nom d’un patient. Il n’est pas possible d’avoir des stocks de réserve non nominatifs dans ce type d’établissement.
Afin de pouvoir gérer des urgences, il est admis qu’un petit stock de médicaments puisse être à disposition des soignants. Ce stock doit être limité à un petit nombre de médicaments comme p.ex. morphine, 1-2 antibiotiques afin de gérer des situations urgentes la nuit et le week-end.
Ce stock peut être géré :
- Soit par la pharmacie en charge de l’assistance pharmaceutique de l’établissement : le stock appartient à la pharmacie. Lorsque l’établissement utilise un médicament de ce stock pour un de ses résidents, il en informe la pharmacie afin qu’elle puisse le facturer au nom du patient et reconstituer le stock d’urgence disponible.
- Soit par le médecin responsable de l’établissement : le stock de médicaments est assimilable à une valise d’urgence, appartenant et géré par le médecin responsable.
En dehors de ces deux situations, tout stock non nominal sera considéré comme une déviation à la norme.
Autre rappel : les médicaments prescrits à un patient et non utilisés en raison d’un changement de traitement, de décès ou de péremption doivent être restitués au pharmacien fournisseur. Ils ne peuvent pas être utilisés ou réutilisés pour d’autres patients (article 30, alinéa 6 du RES).
23 septembre : Abrogation du règlement du 25 mars 1987 sur les stupéfiants (RStup) et modification du RES
En date du 13 août 2025 le Conseil d’Etat a abrogé le règlement du 25 mars 1987 sur les stupéfiants (RStup).
Ainsi, l’envoi des ordonnances dans le cadre des traitements par Agonistes Opioïdes (TAO), de décompte ou information relative à la livraison de stupéfiants n’est plus requis par le Département de la santé et de l’action sociale à compter du mercredi 1er octobre 2025.
Par conséquent, nous vous remercions par avance de garder les ordonnances TAO et tout document y relatif dans vos dossiers. Aucun document envoyé à l’unité de la pharmacienne cantonale à compter du mercredi 1er octobre 2025 ne sera conservé.
De plus, l’article 32 du RES (Règlement du 26 janvier 2011 sur les établissements sanitaires et les établissements apparentés de droit privé dans le canton de Vaud) a également été modifié de la manière suivante : les stupéfiants doivent être tenus sous clé mais il n’est plus nécessaire de les garder séparément des autres médicaments. Ce changement de disposition légale permet de gérer le stockage des semainiers qui contiennent des médicaments et des substances soumises à contrôle.
1er mai : Amélioration de l’accès aux médicaments en cas de pénuries – en particulier pour les médicaments pédiatriques
Les pharmaciennes et pharmaciens cantonaux de Suisse (APC/KAV) ont convenu, avec l’Office fédéral de la santé publique (OFSP) et Swissmedic, d’élargir temporairement la définition de la notion de « cas d’urgence » figurant à l’article 49 de l’ordonnance sur les autorisations dans le domaine des médicaments (OAMéd) pour lutter contre les pénuries de médicaments.
À cet effet, le Département fédéral de l’intérieur a publié un communiqué de presse en date du 29 avril 2025 que vous trouverez ci-dessous.
Communiqué de presse (pdf, 124 Ko)
13 mars : Makatussin® – Délivrance off-label
Nous constatons dernièrement une augmentation des demandes liées à la prescription de Makatussin®, notamment à des posologies hors du cadre prévu par Swissmedic et pouvant alimenter le marché noir. En outre, un élément fréquemment mentionné est qu’il serait utilisé dans le cadre d’un processus de sevrage.
Selon l’indication et les posologies admises, un emballage de Makatussin® Gouttes antitussives ou Makatussin Comp® sirop antitussif permet le traitement de la toux pendant une durée de 5 à 7 jours environ.
De manière générale, le Makatussin n’est pas reconnu comme un traitement de substitution dans le canton de Vaud. De ce fait, une telle prescription devrait être considérée comme une prescription off-label.
Cela implique que la prescription d’un médicament pour une utilisation off-label relève de la responsabilité du médecin qui prescrit et engage également la responsabilité du pharmacien qui remet. En outre, une telle dispensation pourrait ne pas être prise en charge par l’assurance obligatoire des soins. Cet élément doit être systématiquement rappelé au patient.
Par conséquent, il reviendrait à la pharmacie d’accepter ou non la remise de ce traitement et vous avez toujours la possibilité de refuser la remise du traitement si vous avez des soupçons quant à la posologie et à l’utilisation du médicament prescrit.
Pour rappel, toute prescription en lien avec un traitement agoniste de substitution est soumise à autorisation du Médecin cantonal du canton où exerce le médecin prescripteur.
Au cas où une pharmacie vaudoise recevrait une ordonnance pour un traitement agoniste de substitution et/ou pour un traitement psychotrope complémentaire rédigée par un médecin hors canton, elle doit vérifier auprès du Médecin cantonal du canton où pratique le médecin, si le traitement est bien autorisé et si une pharmacie n’a pas déjà été désignée pour la remise du traitement au patient.
11 mars : Remise de pentobarbital sodique pour le suicide assisté
Vous touverez ci-dessous pour information la version 2 du document de l’association des pharmaciens cantonaux (KAV/APC) sur la remise de pentobarbital sodique pour le suicide assisté.
Il est important de relever que EXIT suisse romande va utiliser le modèle de procuration, se trouvant dans ce document, sur l’ensemble des cantons romands.
A toutes fins utiles, vous pouvez également consulter ce document en cliquant ici.
Remise de pentobarbital sodique pour le suicide assisté (pdf, 131 Ko)
21 janvier : Prévention de la violence domestique en pharmacie
Nous avons le plaisir de vous inviter à participer à la formation continue « Violence de couple chez les seniors », animée par Delphine Roulet Schwab, professeure à la Haute Ecole de la Santé La Source.
Cette formation, qui se déroulera le jeudi 30 janvier 2025, de 20 h à 22 h, s’inscrit dans le cadre du cycle de conférence de la Société Vaudoise de Pharmacie (SVPh).
Elle constitue un excellent complément à la formation en ligne « Prévention de la violence domestique en pharmacie ». Cette formation est également ouverte aux assistant∙e∙s en pharmacie.
Pour participer, nous vous invitons à vous inscrire directement sur le site de la SVPh.
17 janvier : Renouvellement des autorisations d’exploiter
Depuis le 1er octobre 2022, l’unité de la Pharmacienne cantonale procède à des inspections de routine systématique en vue du renouvellement des autorisations d’exploiter des pharmacies du canton.
L’inspection est en général fixée un mois avant l’échéance de l’autorisation. Un avis d’inspection vous est transmis au maximum un mois avant la date prévue afin que vous puissiez vous préparer. Les jours suivants l’inspection, vous recevrez la nouvelle autorisation d’exploiter valable pendant 5 ans. Nous tenons à vous rappeler qu’une modification de l’autorisation d’exploiter (changement de pharmacien.ne responsable, modification de l’adresse, etc.) ne repousse pas la date d’échéance initiale de l’autorisation d’exploiter.
Nous avons connaissance des courriers envoyés par la SASIS demandant la prolongation de l’autorisation d’exploiter de la pharmacie. Par conséquent et au vu de ce qui précède, nous vous remercions par avance de vous référer à l’autorisation d’exploiter envoyée par notre service à la suite de l’inspection et de transmettre cette dernière à la SASIS.
2024
13 décembre : Projet Unisanté - DépendAntalgie
Nous vous communiquons qu’Unisanté conduit depuis le 15 octobre 2024, un nouveau projet, soutenu par la Direction générale de la santé de l’Etat de Vaud, nommé DépendAntalgie.
Celui-ci vise à améliorer la sécurité des traitements opioïdes remis en officine et à renforcer le rôle des pharmaciens en matière de prévention à travers des recommandations sur le bon usage de ces médicaments.
Unisanté met à disposition des pharmacies intéressées à participer à cette action du matériel promotionnel (affiches et flyers) ainsi qu’une formation en ligne gamifiée certifiée FPH. L'inscription à la formation est gratuite jusqu’au 15 février 2025.
Nous vous incitons ainsi à prendre connaissance des détails de ce projet sur le site d’Unisanté en cliquant ici.
2 décembre : Suspension de l’envoi des formulaires de vaccinations effectuées dans les pharmacies du canton
Nous vous communiquons que nous suspendons à partir de ce jour, l’envoi des formulaires de vaccinations effectuées dans les pharmacies du canton.
Une réflexion portant sur le recueil des données relatives aux vaccinations dans les pharmacies sera prochainement réalisée. Celle-ci ciblera les outils les plus adaptés afin de mieux évaluer les vaccinations au sein des pharmacies.
Ce travail sera mené en collaboration avec la Société Vaudoise de Pharmacie et nous ne manquerons pas de vous en tenir informés.
12 novembre : Ligne d’assistance en pharmacie clinique et formation continue
Afin de soutenir le bon usage du médicament et l’amélioration de la gestion de la polymédication également dans le milieu communautaire, la Direction Générale de la Santé soutient les pharmacies hospitalières de la Côte (PIC), du Nord Vaudois et de la Broye (PHNVB) et de l’Est Lémanique (PHEL) pour la mise en place d’une ligne d’assistance en pharmacie clinique à disposition des médecins installé∙e∙s et des pharmaciennes et pharmaciens d’officine.
Dès à présent, les pharmaciennes et pharmaciens cliniciens de la PIC, de la PHNVB et de la PHEL se tiennent à votre disposition du lundi au vendredi, pour répondre aux questions relatives aux traitements médicamenteux de vos patient·e∙s (revues de traitement, propositions d’aide à la déprescription, analyses d’interactions médicamenteuses complexes, propositions d’adaptations posologiques, etc.).
Vous trouverez ci-après des flyers détaillant les prestations proposées par chacune des trois pharmacies hospitalières. Ces documents contiennent les numéros de téléphone ainsi que les adresses courriel pour vous permettre de contacter directement les pharmaciennes et pharmaciens cliniciens de votre région.
En complément, des formations continues conjointes médecins-pharmacien∙ne∙s, en lien avec le thème de la polymédication, seront proposées en visioconférence en soirée. Ces formations seront proposées gratuitement et accréditées par des points FPH. Le calendrier des formations sera disponible sur le site de la Société Vaudoise de Pharmacie, qui soutient ce projet novateur de collaboration entre les secteurs hospitalier et ambulatoire.
Nous vous invitons à noter dès à présent la date du 15 janvier 2025, de 19h30 à 21h, pour la première session de formation, dédiée aux hypnotiques et animée par le Professeur Nicolas Schaad, pharmacien-chef de la PIC.
Flyer PHEL (pdf, 635 Ko)
Flyer PHNVB (pdf, 198 Ko)
Flyer PIC (pdf, 15.39 Mo)
16 octobre : Déconditionnement des emballages de Beyfortus
La campagne de prévention du VRS (virus respiratoire syncytial) chez les nourrissons a débuté avec l’arrivée sur le marché suisse des emballages de Beyfortus à 100 mg et à 50 mg.
La difficulté rencontrée est que l’emballage de Beyfortus à 100 mg est conditionné par 5 seringues. Il n’est dès lors pas possible de remettre un emballage et de le facturer en totalité à l’assurance maladie du bébé.
Dès lors, au vu de la situation exceptionnelle et de l’enjeu en termes de santé publique que revêt l’administration de ce médicament dans la prévention du VRS, nous vous autorisons et vous recommandons de déconditionner ces emballages afin de remettre et facturer une seringue de Beyfortus 100 mg sur la base d’une ordonnance d’un pédiatre.
2 octobre : Liste des vaccinations autorisées dans les pharmacies du canton de Vaud
Dans le canton de Vaud, la liste des vaccinations autorisées en pharmacie est discutée entre la Société vaudoise de pharmacie, Médecins de famille Vaud et la Société vaudoise de médecine puis établie par l’Office du médecin cantonal.
La liste des vaccinations en pharmacie vient d’être élargie et comprend notamment :
- La vaccination contre le HPV chez l’adulte, dès son 27ème anniversaire
- La vaccination de rappel contre la diphtérie, le tétanos, la coqueluche
- La vaccination de rappel contre le zona.
Vous trouverez ci-dessous la liste des vaccinations autorisées ainsi que la directive relative à la vaccination dans les pharmacies du canton de Vaud.
Directive relative à la vaccination dans les pharmacies du canton (pdf, 178 Ko)
Liste des vaccinations autorisées (pdf, 40 Ko)
24 septembre : Administration de Beyfortus® et prévention des maladies des voies respiratoires inférieures dues au virus respiratoire syncytial (VRS)
Pour faire suite à la News Pharmacienne cantonale du 22 septembre dernier relative à l’administration du Beyfortus®, vous trouverez ci-après des informations complémentaires dont le courrier du médecin cantonal et ses annexes.
Les annexes comprennent une FAQ relative au Beyfortus® à l’intention des professionnels ainsi qu’un guide d’administration du nirsevimab et enfin le communiqué de presse du 19 septembre du Conseil d’Etat.
Courrier du Médecin cantonal (pdf, 216 Ko)
FAQ pour les professionnels (pdf, 126 Ko)
Guide d'administration (pdf, 276 Ko)
Communiqué de presse (pdf, 170 Ko)
19 septembre : Prévention des maladies des voies respiratoires inférieures dues au virus respiratoire syncytial (VRS)
Le VRS est un virus respiratoire qui provoque en général des symptômes modérés comparables à ceux d’un refroidissement. Toutefois chez les nouveau-nés et les nourrissons, il peut causer des maladies graves susceptibles d’entraîner une pneumonie ou une bronchiolite, causes d’hospitalisation chez les enfants de moins d’un an.
Beyfortus® (nirsévimab), anticorps monoclonal à action prolongée, a été approuvé par Swissmedic pour la prévention des maladies des voies respiratoires inférieures dues au VRS.
Ce traitement est recommandé par la Commission fédérale des vaccinations pour tous les nouveau-nés et nourrissons lors de leur première saison hivernale et constitue une avancée majeure dans la prévention des infections respiratoires dues au VRS.
Dès la mi-octobre, Beyfortus® sera disponible auprès de vos grossistes. Cette solution injectable s’administre par voie intramusculaire et sera conditionnée en seringues de 50 mg ou de 100 mg.
La posologie est à adapter au poids de l'enfant : une dose de 50 mg pour les nourrissons de moins de 5 kg, une dose de 100 mg pour les nourrissons de 5 kg ou plus et enfin une dose de 200 mg pour les enfants à risque âgés de 12 à 24 mois.
L’administration sera réalisée au sein des maternités ou dans les cabinets pédiatriques privés et peut-être concomitante avec les autres vaccins pédiatriques habituels.
A noter que Beyfortus® est pris en charge depuis le 1er septembre 2024 par l’assurance obligatoire des soins et par SwissDRG à partir du 1er octobre 2024.
Des informations supplémentaires vous parviendront dès que possible.
20 juin : Directive relative aux médicaments pouvant être utilisés par les optométristes dans l’exercice de leur profession
Ci-dessous la directive et son annexe relatives aux médicaments pouvant être utilisés par les optométristes dans l’exercice de leur profession dans le canton de Vaud. Cette directive entrera en vigueur le 21 juin 2024.
Conformément à l’article 2 de la directive, seuls les optométristes autorisés à pratiquer dans le canton de Vaud et titulaires d’un bachelor en optométrie HES ou d’un diplôme d’optométriste étranger reconnu en suisse sont autorisés à utiliser les médicaments soumis à ordonnance définis selon l’annexe 1.
Dès lors, avant toute délivrance de ces médicaments, il convient de vérifier ses prérequis dans le registre des professions de la santé NAREG consultable via le lien https://www.nareg.ch
Pour ce faire :
• Introduire sous « recherche de personnes » le nom de l’optométriste
• Cliquer sur le nom de l’optométriste recherché
• Dans la rubrique « professions » les diplômes du professionnel s’affichent. A ce niveau, il doit être fait mention d’un bachelor en optométrie HES ou d’un diplôme d’optométriste étranger reconnu avec le numéro d’enregistrement OPT-FH.
Directive (pdf, 68 Ko)
Annexe à la directive (pdf, 53 Ko)
20 juin : Directive relative à la vaccination dans les pharmacies du canton de Vaud
La vaccination dans les pharmacies du canton de Vaud repose actuellement sur la décision du 17 octobre 2016 du chef du Département de la santé et de l’action sociale (ci-après : la décision) qui fixe notamment les conditions cumulatives nécessaires à l’obtention de l’autorisation cantonale de vacciner. Elle autorise les pharmaciens à vacciner en se basant sur les dispositions de la convention pilote du 1er octobre 2016 établie entre la Société Vaudoise de Pharmacie (SVPh), Médecin famille Vaud (MFVaud) et la Société vaudoise de médecine (SVM).
La convention pilote ayant été remplacée par la convention du 16 janvier 2024 établie entre la SVPh, MFVaud et la SVM (ci-après : la convention), une adaptation de la décision était nécessaire. De plus, l’ajout de la formation de vaccination dans le cursus universitaire des pharmaciens, la possibilité pour les assistantes en pharmacie de vacciner sous responsabilité du pharmacien responsable ont été pris en compte.
La directive relative à la vaccination dans les pharmacies du canton de Vaud qui entre en vigueur le 21 juin 2024 et abroge et remplace la décision concernant la vaccination dans les pharmacies du canton de Vaud.
A compter de cette date :
- Les pharmaciens ne seront plus soumis à autorisation de vacciner. Les certificats de formation complémentaires FPH en vaccination et prélèvements sanguins ne doivent plus nous être envoyés.
- Seule la pharmacie sera autorisée à vacciner. Ladite autorisation sera intégrée à l’autorisation d’exploiter ;
- Les pharmacies n’ayant jamais proposé la prestation de vaccination devront en faire la demande écrite à la pharmacienne cantonale en joignant notamment des photographies du local dans lequel sera effectuée la vaccination. La demande peut se faire par courriel à l’adresse pharmacien.cantonal(at)vd.ch
- Les assistantes en pharmacie au bénéfice d’une formation certifiante aux techniques d’injection intramusculaire pourront réaliser la prestation de vaccination sous la supervision directe d’un pharmacien ayant les compétences requises ;
- Le pharmacien responsable sera tenu de vérifier que les pharmaciens et les assistantes en pharmacie qui réalisent la vaccination remplissent les conditions requises (formation initiale certifiante, formation continue). Un contrôle pourra être effectué lors des inspections relatives au renouvellement des autorisations d’exploiter.
- Les prérequis concernant le local, le respect de la convention, les modalités d’établissement de la liste des vaccinations autorisées, les personnes éligibles à la vaccination et la facturation restent inchangés.
L’autorisation de vaccination sera ajoutée à l’autorisation d’exploiter en cours lorsqu’un changement de pharmacien ou pharmacienne responsable nous sera annoncé ou lors de son renouvellement.
Directive (pdf, 178 Ko)
17 juin : Abrogation de l’ordonnance 3 COVID-19 : Conséquences pour la réalisation des tests SARS-CoV-2 en pharmacie
Le Conseil fédéral a prolongé jusqu’au 30 juin 2024 les dispositions de l’ordonnance 3 COVID-19 relatives à la réalisation de tests rapides antigéniques SARS-CoV-2 par les pharmacies et les cabinets médicaux.
A compter du 1er juillet 2024, date de l’abrogation de l’ordonnance précitée et conformément à l’article 16 la loi du 28 septembre 2012 sur les épidémies (LEp ; RS 818.101), l'utilisation de tests rapides antigéniques SARS-CoV-2 avec application par un professionnel en dehors des laboratoires autorisés par Swissmedic ne sera plus autorisée. Autrement dit, les tests rapides antigéniques SARS-CoV-2 ne pourront plus être effectués en pharmacie.
Les autotests du Sars-CoV-2 à usage personnel bénéficieront quant à eux d’un processus d’autorisation exceptionnelle via l’article 61 alinéa 3 de l’ordonnance du 4 mai 2022 sur les dispositifs médicaux de diagnostic in vitro (Odiv ; RS 812.219) et pourront ainsi toujours être proposées et vendus en pharmacie.
Swissmedic publiera sur son site internet le 1er juillet 2024 des informations plus précises sur le sujet notamment en ce qui concerne la possible utilisation des autotests dans des contextes professionnels particuliers.
27 mai : Préparations à base de cannabidiol (CBD)
Suite un signalement reçu de Swissmedic, nous vous rappelons que la législation concernant les préparations à base de cannabidiol (CBD) n’a pas changé depuis notre communication du 22 octobre 2019 (pdf, 1.97 Mo).
Les préparations à base de CBD sont classées dans une catégorie de produit en fonction notamment de l’utilisation prévue.
Ainsi, les préparation à base de CBD destinées à un usage médical sont considérés comme des médicaments en application de la loi fédérale du 15 décembre 2000 sur les médicaments et les dispositifs médicaux (LPTh ; RS 812.21). Elles doivent avoir été autorisées par Swissmedic ou enregistrées dans un pays doté d’un système d’évaluation identique à celui de la Suisse comme cela est le cas de l’Epidiolex. Elles peuvent aussi être prescrites sous forme de préparation magistrale. La prescription se fait sur une ordonnance simple et la fabrication doit être conforme aux exigences des bonnes pratiques de fabrication (BPF) de la Pharmacopée helvétique en vigueur. Le CBD utilisé pour la fabrication des préparations magistrales doit également être fabriqué conformément aux exigences des BPF.
A noter également que les preuves scientifiques concernant l’efficacité et l’économicité des médicaments à base de CBD sont à ce jour insuffisantes pour justifier d’un remboursement par l’assurance obligatoire des soins. Les médicaments à base de cannabis ne sont donc pas pris en charge par les caisses maladies et un remboursement ne peut être envisagé que dans des cas exceptionnels, après accord du médecin conseil.
Il est également possible de commercialiser des préparations à base de CBD en tant que :
- produit chimique pour un usage technique, par exemple en tant que parfum d’ambiance pour autant que le produit réponde aux dispositions du droit sur les produits chimiques. A ce titre, il ne peut être destiné à la consommation ou à un usage thérapeutique. Il ne peut être ni ingéré ni inhalé. Une décision de portée générale concernant la mise sur le marché d’huile parfumée contenant du CBD a été publiée. Ainsi, les huiles parfumées contenant du CBD enregistrées en tant que produits chimiques ne doivent pas être mise sur le marché ou remises aux consommateurs si elles ne contiennent pas de dénaturant à une concentration appropriée pour décourager l’ingestion abusive par voie orale.
- cosmétique, pour autant que les exigences légales en la matière soient respectées.
En revanche, les préparations à base de CBD ne peuvent en aucun cas être commercialisées en tant que denrées alimentaires que ce soit pour un usage humain ou vétérinaire.
Vous trouverez plus de précision sur le contexte légal du chanvre dans les aliments pour animaux en cliquant ici.
D’une manière générale et vu ce qui précède, les préparations disponibles chez les grossistes ou chez la plupart des fournisseurs ne sont pas conformes et ne respectent pas les dispositions légales en la matière. Leur qualité n’est de plus pas garantie (teneur en CBD, impuretés…). Les fabricants de tels produits n'assument pas ou très peu leurs obligations d'autocontrôle, et par conséquent n'assurent pas non plus la protection des consommateurs. La vente de ces produits engage votre responsabilité et nous ne pouvons que vous recommander de renoncer à proposer ceux-ci à votre clientèle.
15 mai : Directive relative au stockage, à la préparation et à la remise des stupéfiants dans les établissements sanitaires et apparentés
À la suite des modifications apportées dans le tableau relatif à la Directive relative au stockage, à la préparation et à la remise des stupéfiants dans les établissements sanitaires et apparentés, nous avons le plaisir de vous faire parvenir sa nouvelle version en annexe du présent courriel.
Cette directive abroge et remplace la directive du 20 mars 2024 et rentre en vigueur dès aujourd’hui.
Directive (pdf, 181 Ko)
27 mars : Entrée en vigueur de la nouvelle législation sur les précurseurs de substances explosibles
Une nouvelle version de la loi fédérale sur les précurseurs de substances explosibles (LPSE ; RS 941.42) est entrée en vigueur le 1er janvier 2023.
Ce nouveau cadre légal s’inscrit dans la prévention contre le terrorisme, l’accès à ces substances pouvant servir à la confection de bombes artisanales.
En effet, les précurseurs de substances explosibles sont des substances chimiques pouvant être utilisées pour produire des substances explosives. Elles sont souvent contenues dans des produits chimiques à usage domestique et sont répandues dans le commerce.
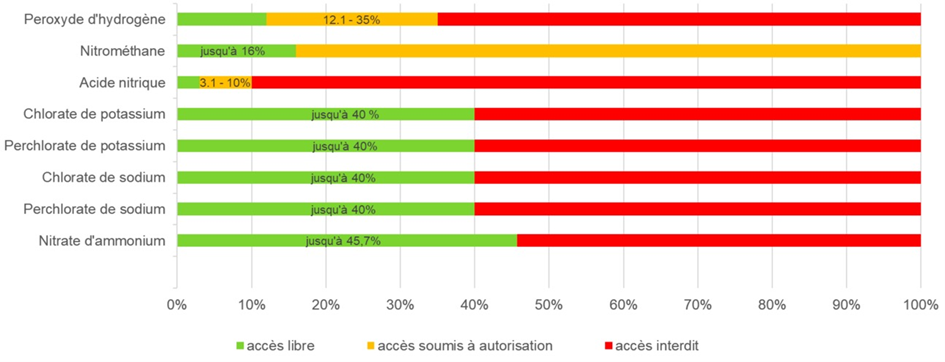
Les précurseurs soumis à des restrictions d’accès conformément à l’annexe 1 de l’ordonnance sur les précurseurs de substances explosibles (OPSE ; RS 941.421) sont les suivants : peroxyde d’hydrogène, nitrométhane, acide nitrique, chlorate de potassium, perchlorate de potassium, chlorate de sodium, perchlorate de sodium et nitrate d’ammonium.
Selon leur concentration en précurseur, ces produits sont librement accessibles, soumis à autorisation ou interdits.
Si vous êtes concernés par la vente de ces précurseurs, nous vous prions de vous familiariser avec le nouveau portail d’information sur les précurseurs mis en place par l’office fédéral de la police. www.fedpol.admin.ch
En effet lors de la vente d’un précurseur, la pharmacie ou la droguerie sera dorénavant tenue de :
- S’enregistrer sur le portail d’information sur les précurseurs FedPol afin de fournir les données nécessaires à l’authentification du point de vente
- Vérifier la validité de l’identité du client
- Vérifier la validité de l’autorisation d’acquisition du client qui devra préalablement la demander sur le portail d’information sur les précurseurs FedPol
- Enregistrer sur le portail d’information sur les précurseurs FedPol la remise du précurseur
- Informer le client des dispositions légales lors de la remise (étiquetage du produit, indications dans la fiche de sécurité).
Si vous avez des questions sur le système d’information sur les précurseurs FedPol, veuillez les adresser directement à : info.precursor(at)fedpol.admin.ch
A toutes fins utiles, vous trouverez une vidéo récapitulative. https://youtu.be/83WKa0mGiUc
Aussi, la police fédérale a désigné la police cantonale pour coordonner la mise en œuvre de ce nouveau cadre législatif au niveau du canton. L’entité de la pharmacienne cantonale a été mandatée pour inspecter les pharmacies et les drogueries en collaboration avec celle-ci. Des contrôles par échantillonnage auront lieu dans les pharmacies et les drogueries par ces autorités compétentes.
14 février : Mise à jour de la base de données des défibrillateurs (AED)
Le réseau vaudois des First responders réunit environ 4000 secouristes prêts à intervenir en cas d’arrêt cardiaque à proximité de leur emplacement afin de démarrer, avant l’arrivée des secours professionnels, les manœuvres de réanimation (massage cardiaque, ventilation, défibrillation).
Dans le cadre de ce réseau et de la mise à jour de la base de données des défibrillateurs (AED) partagée avec la Centrale 144 vaudoise, nous souhaitons nous assurer que votre AED, si vous en possédez un au sein de votre pharmacie, est bien répertorié.
Nous vous invitons à consulter la carte d’emplacement des AED vaudois répertoriés. Si votre appareil n’apparaît pas sur la carte, nous vous remercions de l’annoncer via le formulaire d’annonce des défibrillateurs.
Par ailleurs, si vous ou votre personnel souhaitez adhérer au réseau vaudois des First responders, vous pouvez télécharger l’application First responders Vaud sur iOS ou First responders Vaud sur Android et procéder à l’inscription directement depuis l’app. Une attestation BLS-AED Complet d’un centre de formation (pdf, 1.43 Mo) est nécessaire à l’inscription.
Avez-vous des questions ? Contactez le secrétariat du réseau vaudois des First responders à l’adresse info(at)first-responders-vd.ch ou par téléphone au 021 316 89 80.
17 janvier : Modification de la législation sur les analyses génétiques
Les analyses génétiques au sens de la loi fédérale sur l’analyse génétique humaine (LAGH) sont des analyses visant à déterminer des caractéristiques du patrimoine génétique humain.
Depuis l’entrée en vigueur de la LAGH en 2007, des progrès considérables ont été accomplis dans le décryptage du patrimoine génétique. Aujourd’hui, les caractéristiques d’une personne peuvent être analysées en quelques jours et à des coûts relativement bas. Ces progrès ont d’une part permis d’améliorer le dépistage génétique de certaines maladies. D’autre part, des tests visant à déterminer les caractéristiques génétiques sont de plus en plus souvent proposés sur Internet et donc accessibles au grand public. Parmi ces tests, certains portent sur des caractéristiques ne relevant pas du domaine médical, comme les prédispositions sportives ou l’appartenance à un groupe ethnique (Vikings, Celtes, etc.) pou lesquels la protection contre l’utilisation abusive et le respect du droit de la personnalité ne sont pas garantis.
La révision de l’ordonnance sur l’analyse génétique humaine, entrée en vigueur le 1er décembre 2022, prend en compte cette évolution et a pour effet d’étendre considérablement le champ d’application de la LAGH. La nouvelle loi régit presque tous les types d’analyses génétiques y compris les analyses génétiques effectuées en dehors du domaine médical et celles relatives à des caractéristiques non héréditaires.
Les pharmaciens sont désormais autorisés à prescrire certaines analyses génétiques médicales dans le domaine de la pharmacie ainsi que des analyses génétiques non médicales.
Analyse génétique médicale :
Les analyses pharmacogénétiques pour déterminer la tolérance médicamenteuse peuvent ainsi être prescrites par les pharmaciens pour autant qu’aucune exigence particulière en termes de diagnostic, de conseil ou d’interprétation ne s’y applique.
A noter que si une analyse pharmacogénétique concerne un médicament soumis à prescription médicale, le pharmacien doit préalablement prendre contact avec la personne qualifiée qui a prescrit le médicament.
D’autre part, les analyses pharmacogénétiques peuvent être prescrites uniquement si :
- elles portent sur une sélection définie de variants génétiques ;
- elles permettent d’obtenir des résultats ayant une importance clinique reconnue ;
- des possibilités de traitements préventifs ou curatifs sont disponibles dans l’état actuel des connaissances scientifiques et de la pratique.
Dans les domaines de la pharmacie, seuls les résultats correspondant au but de l’analyse peuvent être communiqués à la personne concernée. La communication de données excédentaires est interdite.
Analyse génétique non médicale :
Dans le domaine non médical, une distinction est faite entre les analyses génétiques à caractéristiques particulièrement sensibles pour lesquelles il faut veiller à la protection de la personnalité et les « autres » types d’analyses génétique.
Sont considérées comme particulièrement sensibles, les analyses portant sur :
- les caractéristiques physiologiques : type de métabolisme en vue d’optimiser l’alimentation, texture musculaire en vue d’optimiser le choix d’un type de sport (vitesse, endurance), vieillissement cutané, etc. ;
- les caractéristiques personnelles : notamment le caractère, le comportement, l’intelligence ou les aptitudes ;
- les caractéristiques ethniques ou relatives à l’origine (« recherche généalogique »)
De telles analyses peuvent être prescrites par un pharmacien autorisé à pratiquer sous sa propre responsabilité professionnelle et ayant acquis dans le cadre de sa formation continue des connaissances en génétique humaine.
Le prélèvement de l’échantillon (en général, salivaire ou buccal) doit avoir lieu en présence du pharmacien ayant prescrit l’analyse (art. 34, al. 3, LAGH).
Les « autres » tests ne fournissant pas d’informations sensibles comme la couleur des yeux, la sensibilité gustative, la consistance du cérumen pourront être proposés directement au client de la pharmacie, y compris par internet.
Protection des données
Quiconque manipule des échantillons ou traite des données génétiques doit respecter certaines règles (art. 3 OAGH). Il est ainsi possible de traiter des données génétiques uniquement si la protection des données est garantie par des mesures techniques et organisationnelles adéquates.
Il faut notamment pouvoir garantir que le résultat de l’analyse soit communiqué uniquement à la personne concernée.
De plus, la personne concernée doit être informée de manière détaillée avant de consentir à une analyse génétique.
Publicité destinée au public
La publicité pour les analyses du domaine médical est interdite. Les pharmaciens habilités à prescrire ce type d’analyse peuvent toutefois en faire faire la promotion dans un cadre limité.
La publicité pour les analyses génétiques dans le domaine non médical est admise sous conditions. Cette publicité doit indiquer les dispositions légales (prescription par un professionnel, interdiction de tester les enfants etc.) et ne pas être mensongère.
Obligations s’appliquant aux laboratoires effectuant les analyses :
Les laboratoires effectuant des analyses génétiques dans le domaine médical doivent disposer d’une autorisation de l’OFSP et disposer d’une accréditation conforme aux normes internationales pertinentes (art. 9 OAGH). Les laboratoires médicaux qui n'effectuent eux-mêmes pas d'analyses génétiques mais qui les transmettent à des laboratoires de génétique ne sont plus soumis à autorisation à condition que la totalité du mandat soit transmise.
Les laboratoires effectuant des analyses génétiques relatives à des caractéristiques particulièrement sensibles dans le domaine non médical sont également soumis à autorisation. Les conditions d’autorisation et les obligations des laboratoires reposent sur les dispositions s’appliquant aux laboratoires du
domaine médical. Les laboratoires doivent disposer d’un système de gestion de la qualité conforme aux normes internationales, mais ne doivent pas être accrédités (art. 41 OAGH).
